L’angolo del confronto: Beliefmore ospita nuovamente Giorgio Terziani
E se fosse tutta una questione di carenza di ossigeno?
Con questa domanda apriamo un nuovo spazio di riflessione in cui Giorgio Terziani torna ad essere ospite di Belief+ per la rubrica “Good Vibes Belief+”, il nostro spazio di riflessione, approfondimento e crescita.
Ti invitiamo a leggere con attenzione queste righe che Giorgio Terziani dedica per spiegare con che forza la carenza di ossigeno impatta su molti aspetti della vita.
Alla fine dell’articolo trovi anche alcuni riferimenti bibliografici per ulteriori approfondimenti.
Prima di lasciarti alla lettura dell’articolo introduciamo brevemente Giorgio Terziani, Visit Professor in Discipline del Benessere Saint George School – Brescia.
É anche relatore, come divulgatore tecnico scientifico, nei congressi medico scientifici nazionali e internazionali su Epigenetica, Ambiente e prevenzione.
Coautore dei libri “La Modulazione fisiologica di Ossigeno On Demand l’ultima sfida della nutraceutica” edito da Edra Edizioni e “Nutraceutica e nutrigenomica” Edito da Tecniche Nuove.
Buona lettura
“L’OSSIGENO, ACCETTANDO GLI ELETTRONI ESTRATTI DA GLICIDI, LIPIDI E AMINOACIDI NEL CORSO DEL CATABOLISMO CELLULARE, CONSENTE AI MITOCONDRI DI SINTETIZZARE L’ATP NECESSARIO PER LE VARIE FUNZIONI VITALI. QUANDO, PERÒ, LA SUA PRESSIONE PARZIALE SCENDE AL DI SOTTO DEI 60 MM DI HG – CONDIZIONE NOTA COME IPOSSIA – ESSO PUÒ ALTERARE A TAL PUNTO LE FUNZIONI CELLULARI DA FAVORIRE LA COMPARSA O ACCELERARE LA PROGRESSIONE DI NUMEROSE MALATTIE, INCLUSE QUELLE NEOPLASTICHE.
L’ipossia favorisce la degradazione del glucosio non ad anidride carbonica ed acqua ma ad acido lattico che, accumulandosi nel microcircolo, attiva inizialmente, attraverso l’abbassamento del pH, importanti meccanismi di compenso, quali la riduzione sia delle resistenze periferiche, con conseguente aumento del flusso sanguigno, sia dell’affinità dell’emoglobina nei confronti dell’ossigeno, con conseguente aumento della biodisponibilità di questo gas.
Tuttavia, se non corretta, la microacidosi indotta dall’ipossia favorisce il rilascio dalle rispettive proteine carrier (trasferrina e ceruloplasmina) di metalli di transizione (ferro e rame) responsabili della trasformazione degli idroperossidi circolanti – prodotti dell’insulto ossidativo cellulare e non più adeguatamente rimossi dalla glutatione-perossidasi (GPx) – in radicali liberi o specie reattive dell’ossigeno (reactive oxygen species, ROS), potenzialmente lesive anche per la matrice extracellulare, con esito finale nella cosiddetta disfunzione endoteliale, momento patogenetico comune a tutte le malattie cardiovascolari.
Inoltre, superato un certo intervallo critico di tempo, l’eventuale ma ormai tardivo ripristino del flusso ematico nel distretto precedentemente ischemico, conduce, per le alterazioni occorse nella fase ipossica, alla generazione di ulteriori ROS, che aggravano l’insulto ossidativo (danno da ischemia-riperfusione) e, se non contrastate efficacemente dalle difese antiossidanti – principalmente affidate alla superossido-dismutasi (SOD), alla GPx ed alla catalasi – portano ad una condizione di stress ossidativo (SO), un fattore emergente di rischio per la salute associato all’invecchiamento precoce e ad almeno un centinaio di patologie, dall’aterosclerosi al cancro.
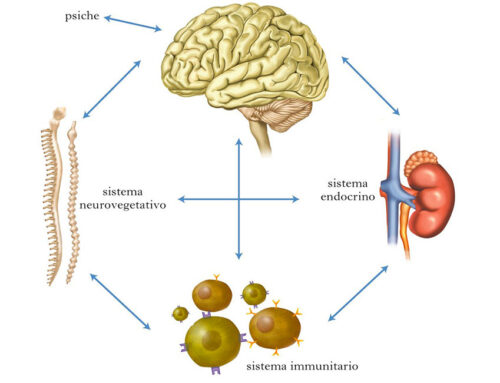
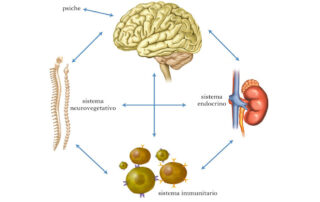
Biodisponibilità dell’ossigeno
Pertanto, il problema metabolico che è alla base della sofferenza cellulare di qualsiasi malattia – come aveva ben preconizzato Guyton – è l’alterata biodisponibilità dell’ossigeno, elemento posto all’estremo terminale della catena di eventi metabolici che conduce alla trasformazione dei nutrienti in energia ma anche punto di partenza per la generazione di specie chimiche ossidanti potenzialmente lesive. Questo concetto è ben esemplificato – già fisiologicamente – dall’attività fisica che, quando eseguita in maniera regolare, favorisce il corretto consumo di ossigeno, riducendo il rischio di ROS in eccesso e stimolando la naturali difese antiossidanti ma, quando effettuata in maniera incongrua – per difetto, ma anche per eccesso – accentua i fenomeni ossidativi.
Purtroppo, sia gli approcci tradizionali volti ad aumentare, in caso di ipossia, il livello di ossigenazione tissutale, quali ad esempio, la terapia iperbarica, sia i trattamenti antiossidanti convenzionali ad alto dosaggio volti a contrastare, in caso di iperossia, l’esuberante produzione di ROS, possono, paradossalmente, aumentare il rischio di SO.
Modulatori fisiologici
In questo scenario, Cellfood® appare come il promettente prototipo di una nuova classe di nutraceutici, i “modulatori fisiologici”, ossia agenti potenzialmente in grado di prevenire o rallentare, attraverso una fine regolazione del metabolismo, la comparsa ovvero influenzare in senso favorevole l’evoluzione di una serie di malattie, spesso a carattere degenerativo e ad andamento cronico, come quelle associate allo SO.
Nella fattispecie, Cellfood® – formulazione colloidale naturale contenente disciolti, in fase disperdente acquosa, deuterio solfato insieme a 17 amminoacidi, 34 enzimi e 78 minerali in tracce – si propone di modulare on-demand la biodisponibilità di ossigeno, aumentandone i livelli in caso di ipossia e contrastando gli effetti indesiderati delle ROS in caso di iperossia, sì da concorrere efficacemente alla normalizzazione del metabolismo ossidativo che è alla base di tutte le funzioni cellulari.
Studi
Alcuni studi in vitro avevano già documentato che Cellfood®, oltre a svolgere – grazie alle sue proprietà colloidali anfotere – un ruolo di modulatore del pH, indispensabile nel controllo dell’acidosi conseguenti all’ipossia, aumenta la quantità di ossigeno disciolto in acqua e, nel contempo, esibisce una potente attività antiossidante (in termini di capacità ferro-riducente). D’altronde, era noto che Cellfood® migliora le performance cardiopolmonari, aumenta i livelli di emoglobina circolante (così mimando la risposta fisiologica all’ipossia) ed abbassa i livelli ematici di acido lattico (così aumentando la capacità di utilizzare l’ossigeno) in maratoneti mentre in soggetti ad elevato rischio di SO (obesi, fumatori di sigaretta ed atleti) esso riduce la produzione di ROS (associata all’iperossia).
In seguito, si è visto che l’assunzione di CF si associa ad un aumento della VO2 max e della potenza massimale in ciclisti professionisti e ad un miglioramento dei sintomi clinici in pazienti affetti da fibromialgia, una malattia correlata allo SO.
Recentemente, in sistemi acellulari, Cellfood® è risultato in grado di proteggere dall’ossidazione indotta da acido ipocloroso sia il glutatione (GSH), il coenzima della GPx, sia il DNA, mentre, in sistemi cellulari, è riuscito a prevenire l’ossidazione degli eritrociti (riducendo la lisi cellulare e la deplezione intracellulare di GSH) e dei linfociti.
Infine, è di questi ultimi mesi uno studio su cellule endoteliali di vena ombelicale umana, nelle quali Cellfood® ha stimolato la velocità di consumo di ossigeno e la sintesi di ATP, mantenendo le concentrazioni intracellulari di lattico deidrogenasi, ed ha inibito la produzione di ROS indotta da ipossia, attraverso la regolazione dell’espressione della SOD manganese-dipendente, di cui è ampiamente nota la funzione antiossidante.
Conclusioni
Confermando le numerose e favorevoli esperienze cliniche, le evidenze scientifi che qui riassunte suggeriscono che l’assunzione di Cellfood® – nel contesto di un’alimentazione equilibrata e di un’attività fisica adeguata – modulando “fisiologicamente” la biodisponibilità di ossigeno ed agendo favorevolmente sulle cellule endoteliali, può risultare utile sia nella prevenzione dell’invecchiamento precoce e delle malattie correlate allo SO in soggetti sani (specialmente se praticanti regolarmente un’attività sportiva) sia nell’integrazione nutrizionale associata a trattamenti medici convenzionali di condizioni morbose acute e croniche legate a uno squilibrio del bilancio ossidativo.
Bibliografia essenziale
- Iorio EL. Hypoxia, free radicals and antioxidants. The Deutrosulfazyme™ paradox. Hypoxia Medical J. 2006. 1-2: 32.
- Benedetti S, et Al. The antioxidant protection of CellfoodTM against oxidative damage in vitro. Food Chemical Toxicol. 2011. 49: 2292–2298.
- Ferrero E, et Al. CellfoodTM improves respiratory metabolism of endothelial cells and inhibits hypoxia-induced ros generation. J Physiol Pharmacol. 2011. 62 (3).
—————————
Chiudiamo ringraziando Giorgio Terziani, generoso divulgatore di nuove conoscenze scientifiche, convinto sostenitore del fatto che condividere, in ogni campo, aiuta la collettività. La conoscenza rende forti.